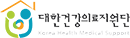전문성 향상을 위한 교육 의무화에 따라 5월 6일부터 총21회 교육
임상적 성능시험 시 식약처장 승인 면제 등 제도개선 추진


식품의약품안전처(처장 김강립)는 ‘체외진단의료기기법’ 시행으로 임상적 성능시험 종사자에 대한 교육이 의무화됨에 따라 전문성 향상을 위해 오는 5월 6일부터 기본(전문)교육을 실시한다.
주요 교육내용은 임상적 성능시험 종사자를 위한 체외진단의료기기 관련 법령, 임상적 성능시험 관리 기준, 그 밖에 임상적 성능시험을 수행하는데 필요한 사항 등이다.
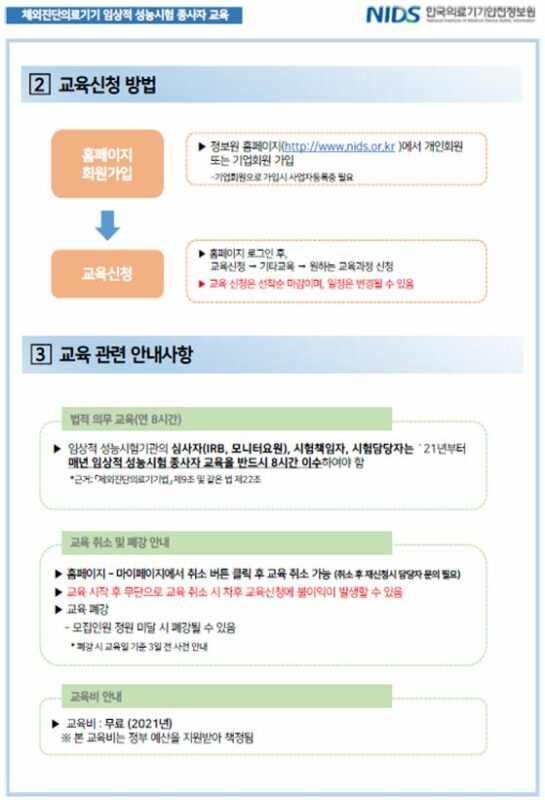
이번 교육은 오는 5월 6일 심사자(IRB) 기본교육을 시작으로 12월까지 총 21회 실시될 예정이며 코로나19 예방 및 확산 방지를 위해 온라인 생중계로 진행한다. 임상적 성능시험 종사자는 4월 28일부터 식약처장이 지정한 교육기관인 ’한국의료기기안전정보원‘을 통해 신청 가능하고 매년 8시간 이상의 교육을 의무적으로 이수해야 한다. 교육을 미 이수할 경우 과태료가 부과된다.
식약처는 체외진단의료기기 연구·개발 지원을 위해 연구자 임상적 성능시험 등의 식품의약품안전처장 승인 면제와 같은 제도개선을 지속적으로 추진하고 있다.
체외진단의료기기 임상적 성능시험은 아래 승인대상을 제외하고 임상적 성능시험기관 심사위원회(IRB)의 승인만으로 수행할 수 있다.
식품의약품안전처장 승인대상 임상적 성능시험으로는 첫째, 인체로부터 검체를 채취하는 방법 둘째, 이미 확립된 의학적 진단방법 또는 허가‧인증받은 체외진단의료기기로는 임상적 성능시험의 결과를 확인할 수 없는 경우 셋째, 동반진단의료기기로 임상적 성능시험을 하려는 경우인데 다만, 이미 허가‧인증받은 의료기기와 사용목적, 작용원리 등이 동등하지 아니한 동반진단의료기기에 한정되는 등 총 세 가지가 있다.
식약처 관계자는 앞으로도 임상적 성능시험 종사자의 전문성 향상을 위해 종사자가 필요로 하는 교육을 마련하고 제도를 합리적으로 개선하는 등 지속적으로 지원하겠다고 밝혔다.






![[대한건강의료신문]-라온피플,-‘의료영상검출·진단보조sw’-혁신의료기기-지정](https://khmnews.co.kr/wp-content/uploads/38979-557949097280026869354624-717753790020-36087957978026645375264205327084-433197576532310360-350312-360x180.jpg)
![[대한건강의료신문]-한-눈에-보이는-체외진단의료기기-허가절차](https://khmnews.co.kr/wp-content/uploads/39065-406464926031043887226331-664-774374-051252273-025726381997277539737788-542334208757-360x180.jpg)
![[대한건강의료신문]-‘의료기기-갱신제’-시작…5년마다-다시-허가받아야](https://khmnews.co.kr/wp-content/uploads/39092-139688790437915173845428-981003826552-832770859-545766179646857-413212-172958148049452-360x180.jpg)
![[대한건강의료신문]-mri-찍을때-금속재료-없는-마스크-사용해야](https://khmnews.co.kr/wp-content/uploads/39110-127204812638925119361961-mri-243104427-930169028694-832134-530377944-597315361574-360x180.jpg)
![[대한건강의료신문]-‘마스크는-입과-코-완전히-가려야-효과있어’](https://khmnews.co.kr/wp-content/uploads/39138-906729906913121419024485-401419461992-832699-975-054086364-679465410-995610141261-360x180.jpg)
![[대한건강의료신문]-라온피플,-‘의료영상검출·진단보조sw’-혁신의료기기-지정](https://khmnews.co.kr/wp-content/uploads/38979-557949097280026869354624-717753790020-36087957978026645375264205327084-433197576532310360-350312-75x75.jpg)
![[대한건강의료신문]-배우-박민영,-줄리스초이스-브랜드-모델로-발탁](https://khmnews.co.kr/wp-content/uploads/40027-537657291755241933399870-048290-954927834-203970116710468631-190540531-694373378-802519-75x75.jpg)